Separazione delle clorofille dai caroteni
Cromatografia su strato sottile di gel di silice
Principi
In primavera e in estate, il colore verde delle foglie è dovuto alla clorofilla, il pigmento che cattura la luce solare per innescare la fotosintesi che, con una serie di complesse reazioni, trasforma l’anidride carbonica e l’acqua in glucosio e ossigeno. Tutti gli organismi fotosintetici contengono clorofilla di tipo a, ma alcune piante hanno anche pigmenti accessori (clorofilla b e c) che permettono di analizzare una gamma più ampia di radiazioni dello spettro solare. Le piante contengono anche pigmenti di colore arancio, giallo e rosso (carotenoidi) e pigmenti di colore rosso o blu (antocianine), che durante la primavera e l’estate sono mascherati dalla clorofilla. In autunno, quando diminuisce l’intensità della luce solare e la temperatura notturna si abbassa, la fotosintesi si arresta e la clorofilla si decompone in amminoacidi, che vanno ad accumularsi nelle radici. Così si attenua il colore verde e diventano visibili gli altri pigmenti, specialmente il rosso e il giallo dei carotenoidi.
I pigmenti vengono estratti dalle foglie di insalata e dalle carote con etere di petrolio. Dapprima lavato con metanolo e acqua, poi essiccato e concentrato su evaporatore rotante. La soluzione così ottenuta viene sottoposta a TLC su gel di silice.
Applicabilità
Quest’analisi si può effettuare sui campioni di origine vegetale che contengano clorofilla e caroteni, si preferisce usare in particolar modo spinaci, insalata e carote.
Apparecchiatura
Camera di sviluppo
Microsiringa da 10m l
Palloni
Burette
Mortaio e pestello
Imbuto separatore
Reagenti
Lastrine di silice G spessore dello strato pari a 2mm
Etere di petrolio 40-70°
Metanolo
Na2SO4 anidro
Eluente: isootanno/ acetone/ etere etilico, 50+25+25 ml
Procedimento
Pesare i due campioni da analizzare,in questo caso 10,13 g di foglie di insalata e 10,08 g di carote, in due mortai di porcellana. Sminuzzare i campioni e aggiungere 25 ml di metanolo, mescolare e lasciare decantare. Si può osservare che il metanolo assume una colorazione verde nel caso dell’insalata e giallo-arancio nelle carote. Dopo circa mezz’ora separare il solvente dal campione macerato. Aggiungere poi 25 ml di metanolo e 35 ml di etere di petrolio; ripetere il trattamento con 25 ml di metanolo e 50 ml di etere di petrolio. Separare le due fasi, che sono insolubili.
Per scartare la fase alcolica inferiore, per evitare che, filtrando, la colorazione rimanga sulle pareti del filtro, pipettare la fase superiore e raccoglierla in un imbuto separatore. Aggiungere 50 ml di acqua distillata e agitare delicatamente.
Aggiungere all’emulsione un cucchiaio di NaCl e scartare la fase acquosa. Raccogliere l’etere rimasto in un palloncino insieme a un cucchiaio di Na2SO4 anidro. Lasciare la soluzione al buio per una mezz’ora, al termine della quale far evaporare l’etere su evaporatore rotante a flusso di azoto, riducendo il volume a 5ml. Mettere la lastrina a termostatare in stufa per circa mezz’ora; una volta raffreddata seminare i due campioni con una microsiringa lungo una linea tracciata con una matita morbida a circa 1,5 cm dal bordo della lastrina. Alla fine porre nella camera di sviluppo per circa 50 minuti. Esaminare qiundi i pigmenti abbastanza velocemente perché si degradano con il passare del tempo.
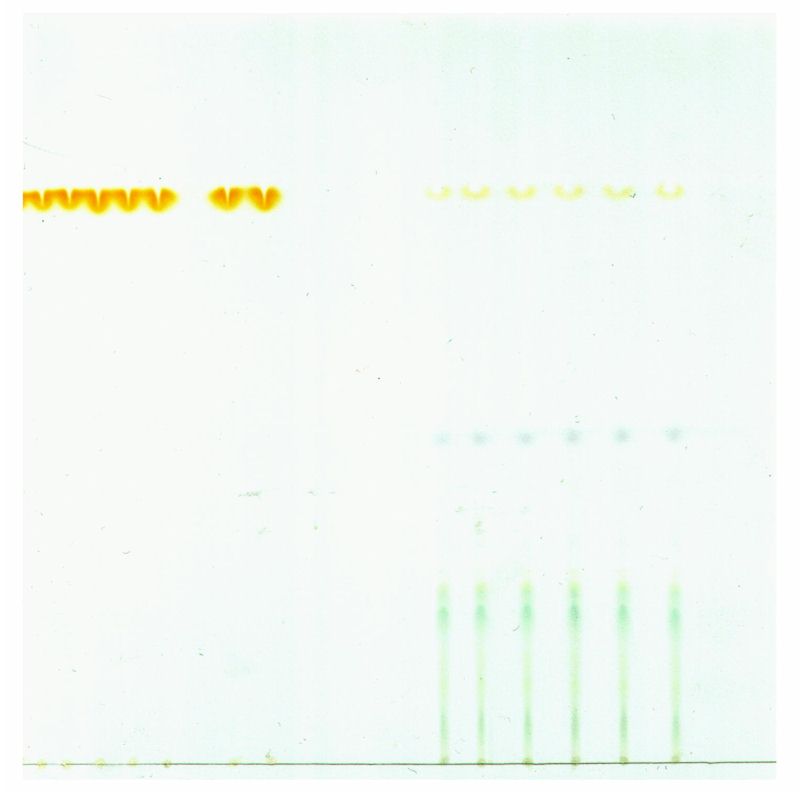
Risultati ottenuti
Abbiamo effettuato il cromatogramma due volte, perché con il passare del tempo i pigmenti si degradano e da una lezione all’altra sulla lastrina non si osservava nulla.

| CAROTENI giallo intenso |
CAROTENI giallo meno intenso |
| CLOROFILLA B azzurro |
|
| CLOROFILLA A verde |
Osservazioni
La separazione dei caroteni è avvenuta in entrambi i campioni; si può osservare che nell’insalata a metà cartogramma è presente la clorofilla B che ha il caratteristico colore verde-blu.