Determinazione del ferro nell’aceto
Principi
Il ferro è quasi sempre presente nelle acque naturali, in quantità che dipendono dalla costituzione geologica del suolo, in forma colloidale o legato a composti organici (umati). Il Fe(II) è la forma caratteristica delle acque sotterranee. Il Fe(III), invece, è da considerarsi praticamente insolubile, in quanto precipita sotto forma di idrossido. Per un’acqua potabile il valore guida, ovvero la concentrazione massima di ferro preferibile è di 0,1 mg/l; la concentrazione massima ammissibile, invece, è di 1,0 mg/l. per valori superiori a questo, l’acqua acquista un gusto e una colorazione sgradevoli e aumentano le probabilità di una proliferazione di ferrobatteri.
Il ferro, portato in soluzione, viene ridotto a ione ferroso mediante un trattamento con idrossilammina in ambiente acido. Lo ione ferroso, in presenza di orto fenantrolina forma il complesso [(C12H8N2)3Fe]2+, stabile e di colore rosso-arancio.
L’intensità del colore e la sua tonalità non sono influenzate da variazioni di pH nell’intervallo fra 3 e 9. un pH fra 2,9 e 3,5 e un eccesso di orto fenantrolina assicurano un rapido sviluppo del colore.
Applicabilità
Il ferro può essere determinato in qualsiasi aceto
Apparecchiatura
Spettrofotometro doppio raggio
Cuvette di vetro
Matracci tarati da 100 ml
Pipette graduate
Reagenti
Soluzione standard concentrata di ferro (200mg/l)
Soluzione standard diluita di ferro (10mg/l)
Soluzione di idrossilammina cloridrato al 10% in acqua distillata
Soluzione di o-fenantrolina allo 0,5% in acqua
Soluzione tampone
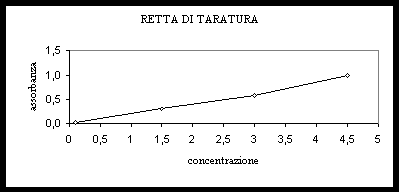
Retta di taratura
Trasferire in matracci da 100ml 1-15-30-45 ml della soluzione diluita di ferro. Aggiungere un po’ d’acqua distillata, 2ml di HCl concentrato e 1ml di idrossilammina. Aspettare dieci minuti in modo tale che la riduzione del ferro (da Fe(II) a Fe(III)) fosse completa.
Aggiungere dieci ml di tampone e 2ml di o-fenantrolina, contemporaneamente, preparare il bianco secondo le stesse modalità, ma escludendo la soluzione di ferro.
Dopo circa 20 minuti dall’aggiunta dell’o-fenantrolina leggere l’assorbanza.
Soluzione diluita |
Ferro (mg/l) |
A510 |
1 |
0,1 |
0,0200 |
15 |
1,5 |
0,2994 |
30 |
3 |
0,5804 |
45 |
4,5 |
0,9927 |

Procedimento
Trasferire in un becher 100 ml di aceto; aggiungere 2 ml di HCl concentrato, 1 ml di idrossilammina cloridrato. Scaldare ed evaporare fino ad ottenere un volume di circa 50 ml. Raffreddare le soluzioni e aggiungere 10 ml di soluzione tampone; in seguito trasferire in diversi matracci tarati da 100 ml e aggiungere 2 ml di o-fenantrolina portando poi a volume. Misurare l’assorbanza a 510 nm dopo 20 minuti.
Per la preparazione del campione di aceto, filtrare preventivamente i 100 ml di soluzione con carbone attivo per eliminare la leggera colorazione di questo prodotto.
Risultati ottenuti
Per trovare la concentrazione in mg/l di Fe contenuta nei campioni abbiamo ricorso alla formula:
vvvC
Fe (mg/l) = ----- x 100
gggggVx
C= concentrazione di Fe in mg/l
Vx= volume in ml di campione utilizzato
La concentrazione di Fe (mg/l) per 100 ml di campione analizzato è la seguente:
1,7601 mg/l misurata a 510 nm.
Osservazioni
La concentrazione di ferro rilevata nell’aceto bianco si è dimostrata pari a 1,76 mg/l.